Diagnostic et prise en charge du glaucome: Et si nous pouvions intervenir plus tôt?
Le glaucome est une maladie oculaire aux multiples facettes, qui implique une dégénérescence du nerf optique caractérisée par une perte de cellules ganglionnaires de la rétine.

Deuxième cause de cécité après la cataracte, cette affection représente un problème de santé publique important. Et contrairement à la cataracte, la perte de vision qui résulte du glaucome est irréversible. Dans le monde, on estime que 70 millions de personnes pourraient être touchées par le glaucome primaire à angle ouvert en 2020. Ce nombre devrait atteindre 111,8 millions en 2040. (1)
Pathogénie
Malgré l’ubiquité du glaucome, notre compréhension de sa pathogénie reste incomplète. Le principal facteur de risque connu de la maladie est l’augmentation de la pression intraoculaire (PIO), mais les personnes ayant une PIO normale peuvent également développer un glaucome. En fait, le glaucome dit à tension normale représente la moitié des cas de glaucome aux États-Unis et jusqu’à 90 % des cas au Japon. (2) Cela renforce le fait que la PIO n’est pas la seule cause de l’atteinte du nerf optique et que, très souvent, le glaucome progresse malgré les traitements intensifs de réduction de la PIO. Nous savons maintenant que de nombreux facteurs influencent le développement du glaucome, notamment des éléments héréditaires, vasculaires, immunitaires et structurels. (1)
Délai de diagnostique
Le glaucome est souvent asymptomatique dans ses premiers stades. C’est entre autres pour cette raison qu’il peut être difficile à détecter. (1) Une étude a révélé un retard de diagnostic dans 43% des cas de glaucome et un quart des cas avaient un retard de diagnostic total allant de 3 à 27 ans. (3) Cette situation est préoccupante, car il existe un risque significatif de perte de vision au cours de cette période. Une prise en charge plus précoce peut retarder, voire prévenir, une déficience visuelle au cours de la vie. (3) Le faible statut socio-économique joue un rôle dans les retards de diagnostic, car les individus peuvent ne pas avoir accès aux ressources nécessaires à la détection. Cependant, les facteurs individuels ne sont pas les seules influences en jeu. Les défaillances au niveau des prestataires de soins de santé jouent également un rôle dans les retards de diagnostic, en raison de l’imprécision de la détection des cas et/ou du retard dans l’orientation des patients. (4)
Un nombre croissant d’études montre que des changements physiologiques tels qu’une dérégulation du flot sanguin ont lieu bien avant que les dommages irréversibles ne surviennent.
Outils de diagnostic
Pour comprendre comment le diagnostic et la prise en charge du glaucome peuvent être améliorés, examinons comment le glaucome est dépisté en ce moment.
Examen du champ visuel
L’examen du champ visuel vise à identifier une perte fonctionnelle de la vision. Plusieurs paramètres peuvent être analysés pour évaluer l’étendue de la perte du champ visuel. La moyenne de déviation (MD) donne une moyenne pondérée de la perte de champ sur l’ensemble du champ visuel. Pour ce faire, il compare la sensibilité globale à celle de sujets témoins appariés selon la même tranche d’âge. (5) La déviation du modèle standard (PSD) utilise également des témoins appariés selon l’âge, mais examine la différence de sensibilité entre des points adjacents. (6) D’autres mesures peuvent également être utilisées, comme l’index du champ visuel (VFI) et l’analyse de progression du glaucome (GPA).
Bien que l’examen du champ visuel soit un excellent moyen de mesurer la perte de vision à un stade avancé de la maladie, il faudrait pouvoir diagnostiquer le glaucome avant qu’une déficience fonctionnelle irréversible ne se manifeste.
Photographie de la rétine
Photographier le nerf optique peut aider à visualiser les changements de sa structure au fil du temps. La dégénérescence du nerf optique liée au glaucome entraîne un élargissement généralisé du bord de l’excavation de la papille, qui peut être mesuré par le ratio “cup/disc”. (7) Un ratio croissant dans le temps signale une perte progressive des axones des cellules ganglionnaires de la rétine. La photographie peut aider à visualiser l’élargissement ou l’asymétrie de l’excavation par rapport au disque, l’hémorragie papillaire ou la perte de la couche de fibres nerveuses, qui font tous suspecter un glaucome. (8)
Si la photographie du fond d’œil est utile pour illustrer les modifications du nerf optique au fil du temps, ces nuances ont tendance à être subtiles et donc difficiles à visualiser sur de courtes périodes. De plus, ces altérations ne peuvent pas être quantifiées avec la photographie. Ainsi, le temps qu’un changement soit visible, la perte structurelle, elle aussi irréversible, peut-être importante.
Tomographie par cohérence optique
La tomographie par cohérence optique (OCT) est un autre outil utilisé pour dépister le glaucome. Cette technologie quantifie la topographie du disque et de la macula, ainsi que l’épaisseur de la couche de fibres nerveuses et du complexe des cellules ganglionnaires autour du nerf optique et de la macula. (8) La surveillance par OCT permet d’identifier un changement dans ces couches au fil du temps.
Bien que l’OCT soit un outil utile pour le diagnostic du glaucome, il présente certaines limites. En effet, la délimitation du nerf optique peut être imprécise dans certains cas. (9) Certaines conditions rendent également particulièrement difficile la production de données précises et utiles par l’appareil, comme une myopie élevée, un disque oblique ou une atrophie péripapillaire étendue. En outre, l’OCT mesure la perte structurelle, qui est malheureusement toujours irréversible.
Technologies futures
Et si nous pouvions trouver des indices d’un glaucome imminent avant qu’il y ait une perte structurelle, et encore moins un déclin fonctionnel? Si nous pouvions identifier la perte de fonction métabolique responsable de la détérioration éventuelle du tissu du nerf optique, nous pourrions intervenir plus tôt.
Un nombre croissant d’études montre que des changements physiologiques tels qu’une dérégulation du flot sanguin ont lieu bien avant que les dommages irréversibles ne surviennent. (10)
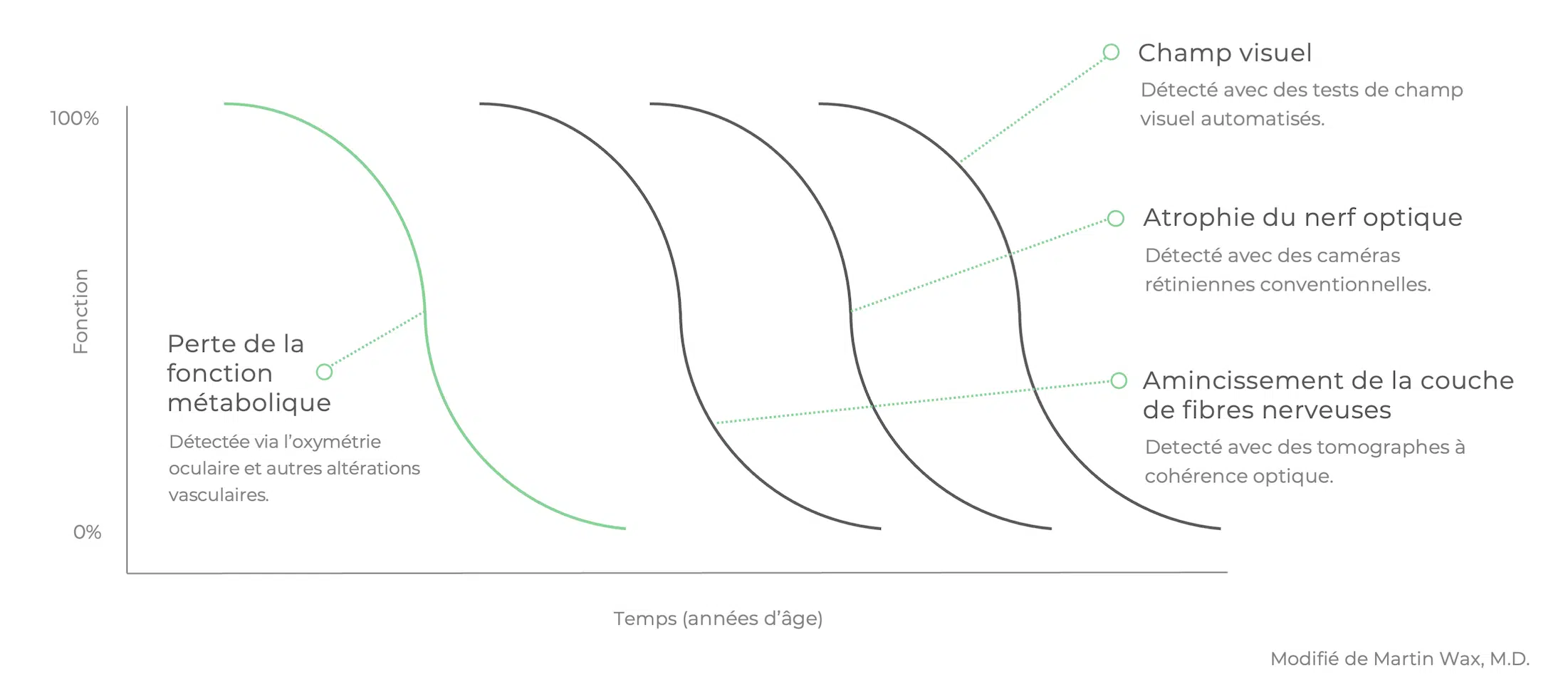
Oximétrie oculaire
La mesure de l’oxymétrie oculaire permet d’évaluer la fonction métabolique, ce qui pourrait mener à un diagnostic plus précoce des maladies oculaires telles que le glaucome. Cette technologie pourrait également servir à évaluer la réponse métabolique afin de mieux adapter le traitement au fil du temps.
Zilia Ocular est une caméra rétinienne permettant la mesure continue de l’oxygénation dans des régions ciblées de l’œil. Cette technologie combine imagerie et oxymétrie pour la mesure non invasive de la fonction métabolique.
L’utilisation de l’oxymétrie oculaire pourrait révolutionner la façon dont nous abordons le dépistage, le diagnostic et le traitement du glaucome dans le monde entier. En identifiant la maladie avant que des dommages structurels et fonctionnels ne surviennent, des thérapies actuelles ou innovantes pourraient intercepter la pathophysiologie de la maladie à un stade plus précoce du processus. Des recherches en cours visent à déterminer quelles sont les thérapies les plus efficaces pour lutter contre le dérèglement de l’approvisionnement en oxygène. Jusqu’à présent, il semble que les inhibiteurs de l’anhydrase carbonique, le magnésium et les inhibiteurs calciques puissent être bénéfiques pour cibler cette voie. (11) Nous savons que la réduction de la PIO ne traite pas tous les facteurs qui jouent un rôle dans le glaucome. De nouvelles cibles médicamenteuses sont donc nécessaires pour traiter cette maladie plus efficacement et contrer la perte de vision qui y est rattachée.
Conclusion
La prévalence croissante du glaucome et le retard dans son diagnostic constituent des problèmes de santé publique. Zilia Ocular pourrait servir à détecter le glaucome avant qu’il n’ait la possibilité de ravager la structure et la fonction de l’œil. En identifiant plus tôt le dysfonctionnement métabolique, des traitements pourraient être initiés de manière préventive, en utilisant les thérapies actuelles et/ou des nouvelles thérapies. L’identification et le traitement précoces du glaucome offrent un potentiel important pour prévenir la perte de la vision, améliorant ainsi la qualité de vie de millions de personnes dans le monde.
Références
- Allison K, Patel D, Alabi O. Epidemiology of Glaucoma: The Past, Present, and Predictions for the Future. Cureus. 2020;12(11):e11686. Published 2020 Nov 24. doi:10.7759/cureus.11686
- Baneke AJ, Aubry J, Viswanathan AC et al.The role of intracranial pressure in glaucoma and therapeutic implications. Eye. 2020;34:178–191. doi:10.1038/s41433-019-0681-y
- Eissa IM, Abu Hussein NB, Habib AE, El Sayed YM. Examining Delay Intervals in the Diagnosis and Treatment of Primary Open Angle Glaucoma in an Egyptian Population and Its Impact on Lifestyle. J Ophthalmol. 2016;2016:7012826. doi:10.1155/2016/7012826
- Prior M, Francis JJ, Azuara-Blanco A, Anand N, Burr JM; Glaucoma screening Platform Study group. Why do people present late with advanced glaucoma? A qualitative interview study. Br J Ophthalmol. 2013;97(12):1574-1578. doi:10.1136/bjophthalmol-2013-303813
- Saunders LJ, Russell RA, Kirwan JF, McNaught AI, Crabb DP. Examining visual field loss in patients in glaucoma clinics during their predicted remaining lifetime. Invest Ophthalmol Vis Sci. 2014;55(1):102-109. Published 2014 Jan 7. doi:10.1167/iovs.13-13006
- Heo DW, Kim KN, Lee MW, Lee SB, Kim CS. Properties of pattern standard deviation in open-angle glaucoma patients with hemi-optic neuropathy and bi-optic neuropathy. PLoS One. 2017;12(3):e0171960. Published 2017 Mar 1. doi:10.1371/journal.pone.0171960
- Weinreb RN, Aung T, Medeiros FA. The pathophysiology and treatment of glaucoma: a review. JAMA. 2014;311(18):1901-1911. doi:10.1001/jama.2014.3192
- An G, Omodaka K, Hashimoto K, et al. Glaucoma Diagnosis with Machine Learning Based on Optical Coherence Tomography and Color Fundus Images. J Healthc Eng. 2019;2019:4061313. Published 2019 Feb 18. doi:10.1155/2019/4061313
- Sathyan P, Shilpa S, Anitha A. Optical Coherence Tomography in Glaucoma. J Curr Glaucoma Pract. 2012;6(1):1-5. doi:10.5005/jp-journals-10008-1099
- Wentz SM, Kim NJ, Wang J, Amireskandari A, Siesky B, Harris A. Novel therapies for open-angle glaucoma. F1000Prime Rep. 2014;6:102. Published 2014 Nov 4. doi:10.12703/P6-102
- Mozaffarieh M, Flammer J. Is there more to glaucoma treatment than lowering IOP?. Surv Ophthalmol. 2007;52 Suppl 2:S174-S179. doi:10.1016/j.survophthal.2007.08.013
Publié par l’équipe Zilia le 16 septembre 2021
Lecture additionnelle
Zilia et l’Université de Kagawa lancent une étude sur l’oxygénation de la rétine au Japon
Québec, le 30 avril 2024 - Zilia, une entreprise québécoise spécialisée dans le développement de...
Le rôle complexe de l’oxygène dans la rétinopathie du prématuré
La naissance prématurée se présente comme l'un des accomplissements les plus notables de la médecine....
Le stress oxydatif et la santé des yeux
L'oxygène occupe une place primordiale dans notre univers, étant le troisième élément le plus abondant et le...
Solutions