Oxymétrie oculaire: Un changement de paradigme dans la gestion des occlusions veineuses rétiniennes?
L’occlusion veineuse rétinienne (OVR) touche plus de 1,1 million de personnes aux États-Unis et est considérée comme l’une des principales causes de perte de vision chez les personnes âgées. (1)
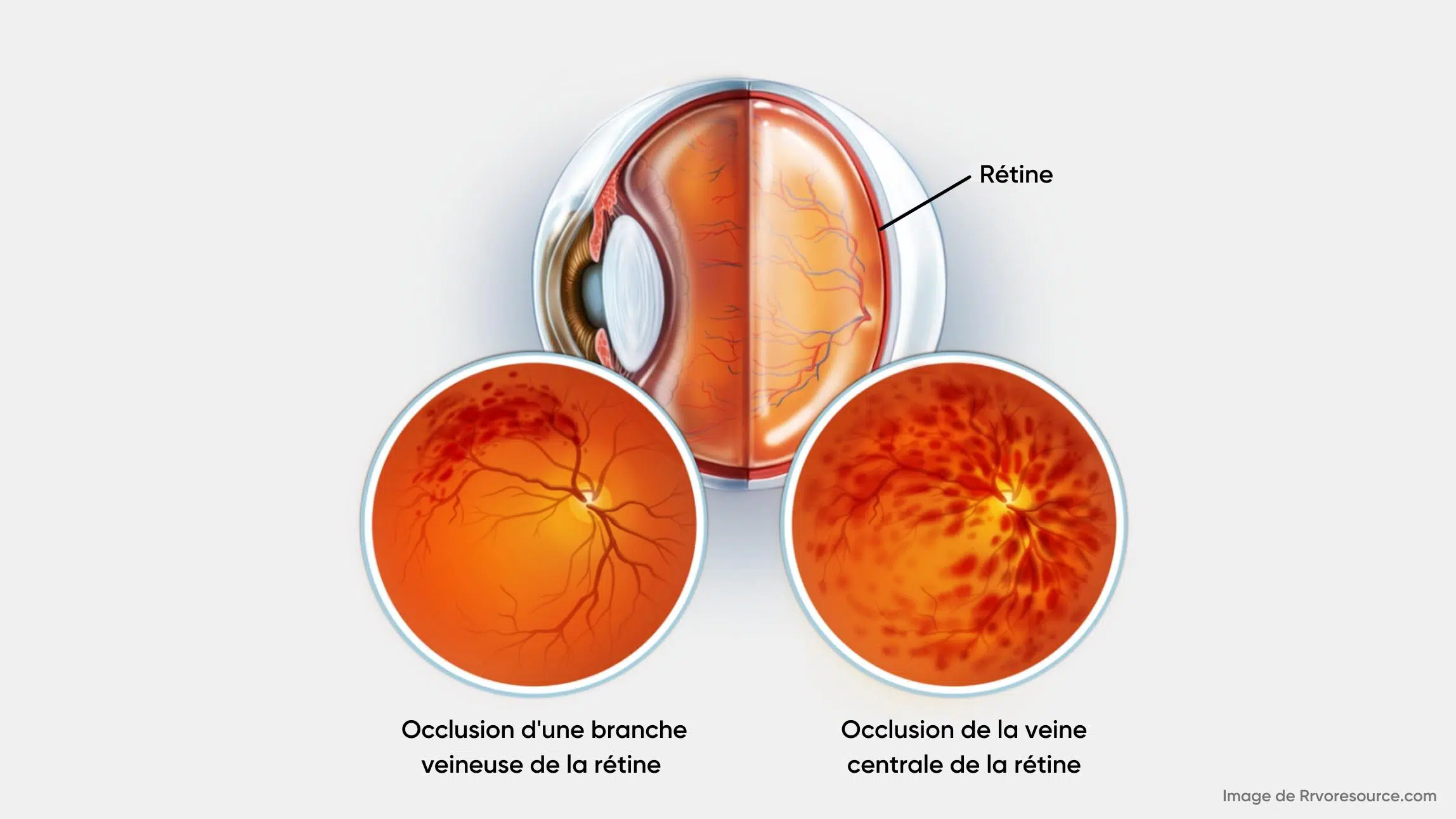
Il existe deux types d’OVR selon la localisation de l’obstruction: occlusion de la veine centrale de la rétine (OVCR) et occlusion d’une branche veineuse de la rétine (OBVR). (2) L’OVCR se produit lorsqu’il y a une obstruction de la veine rétinienne principale en arrière de la lame criblée du nerf optique et est typiquement le résultat d’une thrombose. L’OVCR peut être subdivisée en deux catégories : ischémique (non perfusée) et non ischémique (perfusée). Environ 70 % des cas sont non ischémiques et se caractérisent par une acuité visuelle relativement bonne (supérieure à 20/200), un défaut pupillaire afférent faible ou absent et des changements visuels légers. Les 30 % de cas restants sont ischémiques, se manifestent par une non-perfusion capillaire rétinienne d’au moins 10 diamètres de disque et présentent généralement un mauvais pronostic visuel. (2) L’hypoxie qui en résulte peut augmenter le facteur de croissance de l’endothélium vasculaire (VEGF), induisant œdème maculaire et/ou néovascularisation de l’iris ou de la rétine. (3)
L’OBVR, quant à elle, est une occlusion survenant dans l’une des branches de la veine centrale de la rétine. (2) Le symptôme le plus courant de l’OBVR est une vision floue ou une perte de vision dans une partie de l’oeil. Elle peut survenir soudainement ou se développer progressivement sur plusieurs heures ou jours.
Physiopathologie, épidémiologie et facteurs de risque
La prévalence globale de l’OVR chez les personnes âgées de 30 à 89 ans était estimée en 2015 à 28 millions de personnes. (5) L’âge est un facteur de risque important pour le développement de l’OVR avec 90 % des patients atteints ayant plus de 50 ans. (2) Les autres facteurs de risque sont le glaucome, les drusens et l’œdème papillaire, l’état d’hypercoagulation, la syphilis, la sarcoïdose, la race afro-américaine, la drépanocytose, le virus de l’immunodéficience humaine (VIH), la vascularite, la prise de certains médicaments tels les contraceptifs oraux et les diurétiques, les troubles de la fonction plaquettaire, une maladie orbitaire et, rarement, les migraines. (2)
La thrombose étant la principale cause de l’OVR, les conditions médicales entraînant une augmentation des éléments contribuant à la thrombose, comme la stase veineuse, les lésions endothéliales ou l’hypercoagulabilité, pourraient entraîner une OVR. (2) Enfin, les habitudes de vie telles que la consommation d’alcool et le tabagisme peuvent également avoir un impact direct sur l’OVR car elles contribuent à l’hypertension, au diabète et à l’hyperlipidémie, qui sont tous des facteurs de risque connus de maladies vasculaires rétiniennes. (4)
Diagnostic
Le diagnostic de l’OVR se fait principalement par un examen oculaire approfondi qui comprend une évaluation du fond d’œil sous dilatation. Une fois la dysfonction vasculaire constatée, la photographie du fond d’œil peut être utilisée à des fins d’éducation du patient et pour suivre l’évolution de la maladie au fil du temps. La tomographie par cohérence optique (OCT) est également utile pour vérifier la présence ou l’absence d’un œdème maculaire, ce qui peut influer sur la prise en charge de l’affection. L’angiographie à la fluorescéine (AF) est une approche plus invasive pouvant être utilisée pour déterminer l’état de perfusion de la rétine et évaluer de manière qualitative la déficience en oxygénation dans les tissus. L’avènement de l’angiographie par tomographie à cohérence optique (OCT-A) offre un moyen alternatif et non invasif d’imager les réseaux capillaires rétiniens profonds et superficiels. En fait, cette technologie s’est avérée plus efficace que l’AF pour visualiser et analyser le réseau capillaire de la macula, ainsi que pour détecter les œdèmes maculaires. (6) Malheureusement, cette technologie n’est pas sans limitations, car l’OCT-A est sujet à divers artefacts tels que des artefacts d’ombrage associés à une hémorragie intrarétinienne/sous-rétinienne, des artefacts de projection des vaisseaux rétiniens superficiels sur les couches rétiniennes plus profondes et des artefacts liés au mouvement. (12)
Traitement
Il existe de nombreuses interventions thérapeutiques pour l’OVR, notamment la thérapie au laser, les agents anti-VEGF, les stéroïdes et la chirurgie. (6) Dans l’ensemble, les agents anti-VEGF sont aujourd’hui au cœur du traitement de l’OVR.
Dans la quête de nouveaux biomarqueurs hémodynamiques, de grands progrès ont été réalisés dans la compréhension de l’importance du dérèglement de l’oxygénation dans l’OVR.
Oxymétrie des vaisseaux rétiniens
Au cours de la dernière décennie, de nombreuses études utilisant des oxymètres traditionnels à deux longueurs d’onde ont révélé que la saturation en oxygène dans les gros vaisseaux sanguins est affectée dans l’OVR. Dans une étude normative, la saturation moyenne estimée (±SD) en oxygène de l’hémoglobine chez des individus sains était de 92,2 ± 3,7% dans les artères et de 55,6 ± 6,3% dans les veines. (11) On a constaté que ces valeurs dans les veinules rétiniennes des yeux affectés par l’OVCR sont significativement plus faibles que celles des yeux non affectés. Cela est probablement dû au fait que l’obstruction vasculaire entraîne une diminution du flux sanguin, et donc une réduction de l’apport d’oxygène aux tissus. Les tissus hypoxiques consomment plus d’oxygène du sang car le flux vasculaire à travers le lit capillaire est diminué. En revanche, la saturation artériolaire ne diffère pas de manière significative entre les yeux affectés et les yeux non affectés. (8) Ceci est cohérent avec la physiopathologie connue de l’OVCR.
En outre, il a été démontré qu’il existe des différences interindividuelles dans les mesures d’oxymétrie des vaisseaux rétiniens dans l’OVR. L’obstruction diffère d’un patient à l’autre, en raison de divers mécanismes compensatoires initiés par l’occlusion veineuse. La canalisation progressive du thrombus, ainsi que le développement de vaisseaux collatéraux, contribuent également à cette variabilité. (11) Les recherches suggèrent également que, lors du diagnostic, la saturation en oxygène des veinules rétiniennes serait corrélée avec l’acuité visuelle corrigée du meilleur œil.
Nouvelle approche de l’oxymétrie oculaire
Si les études susmentionnées ont joué un grand rôle dans l’établissement du lien entre l’oxygénation des vaisseaux rétiniens et l’OVR, elles comportent également d’importantes limitations dues aux technologies utilisées pour effectuer les mesures. En effet, les appareils d’oxymétrie standard à deux longueurs d’onde ne fournissent que des mesures relatives de saturation en oxygène dans les gros vaisseaux sanguins du fond de l’œil. Cette limitation empêche l’évaluation de tissus spécifiques tels que la rétine ou la tête du nerf optique.
Pour devenir cliniquement pertinentes, les mesures d’oxymétrie doivent devenir fiables, reproductibles et s’adapter à différents protocoles d’acquisition, ainsi qu’à des mesures statiques et dynamiques à différents endroits du fond de l’œil. C’est pourquoi Zilia a lancé sur le marché de la recherche, Zilia Ocular, la première caméra rétinienne permettant la mesure de la saturation en oxygène dans des régions ciblées de la rétine. Cette nouvelle technologie ouvre la voie à l’étude non invasive de l’oxygénation dans des contextes de réponse métabolique, de processus pathophysiologiques et de suivis thérapeutiques.
Cette nouvelle approche pourrait fournir de nouvelles informations cruciales sur l’état de perfusion de la rétine avec le but ultime d’améliorer le diagnostic, le pronostic et le suivi du traitement de conditions comme l’OVR.
Conclusion
L’OVR est une cause importante de perte de vision chez les personnes âgées, surtout si l’on considère l’augmentation des taux de maladies prédisposantes. Les outils de diagnostic traditionnels reposent sur des mesures invasives pour générer des données qualitatives sur la perfusion rétinienne. Dans la quête de nouveaux biomarqueurs hémodynamiques, de grands progrès ont été réalisés dans la compréhension de l’importance du dérèglement de l’oxygénation dans l’OVR. Cependant, l’abondance des recherches effectuées à l’aide d’oxymètres de vaisseaux rétiniens ne s’est pas encore traduite par le déploiement de ces technologies en milieu clinique, principalement en raison d’un manque de précision et de polyvalence. S’appuyant sur le spectre complet de la lumière, la technologie de Zilia a le potentiel de surmonter ces limitations en recueillant des données quantitatives d’oxymétrie oculaire dans les tissus de l’œil, de manière non invasive, dans le but de permettre une meilleure prise en charge de l’OVR.
Références
1. Klein R, Klein Be, Moss Se, Meuer Sm. The epidemiology of retinal vein occlusion: The beaver dam eye study. Trans Am Ophthalmol Soc. 98, 133-141; discussion 141-133 (2000).
2. Blair K, Czyz CN. Central Retinal Vein Occlusion. In: StatPearls. StatPearls Publishing, Treasure Island (FL); 2021. PMID: 30252241.
3. Ehlken C, Rennel E, Michels D et al. Levels of VEGF but not VEGF165b are Increased in the Vitreous of Patients With Retinal Vein Occlusion. Am J Ophthalmol. 2011;152 (2):298-303.e1. doi:10.1016/j.ajo.2011.01.040
4. Thapa R, Bajimaya S, Paudyal G et al. Prevalence, pattern and risk factors of retinal vein occlusion in an elderly population in Nepal: the Bhaktapur retina study. BMC Ophthalmol. 2017;17(1). doi:10.1186/s12886-017-0552-x
5. Song P, Xu Y, Zha M, Zhang Y, Rudan I. Global epidemiology of retinal vein occlusion: a systematic review and meta-analysis of prevalence, incidence, and risk factors. J Glob Health. 2019;9(1):010427. doi:10.7189/jogh.09.010427
6. Seknazi D, Coscas F, Sellam A, Rouimi F, Coscas G, Souied E, Glaget-Bernard A. Optical Coherence Tomography Angiography in Retinal Vein Occlusion. Retina. 2018;38(1):1562–1570. doi: 10.1097/IAE.0000000000001737
7. Schmidt-Erfurth U, Garcia-Arumi J, Gerendas B et al. Guidelines for the Management of Retinal Vein Occlusion by the European Society of Retina Specialists (EURETINA). Ophthalmologica. 2019;242 (3):123–162. doi:10.1159/000502041
8. Hardarson SH, Stefánsson E. Oxygen saturation in central retinal vein occlusion. American journal of ophthalmology. 2010;150 (6):871-5. doi: 10.1016/j.ajo.2010.06.020
9. Krejberg Jeppesen S, Sín M, Hakon Hardarson S, Bek T. Retinal oximetry does not predict 12-month visual outcome after anti-VEGF treatment for central retinal vein occlusion: A multicentre study. Acta Ophthalmol. 2021;99(7): e1141-e1145. doi:10.1111/aos.14744
10. Yoneya, S, Saito, T, Nishiyama, Y, Deguchi, T, Takasu, M, Gil, T, & Horn, E. Retinal oxygen saturation levels in patients with central retinal vein occlusion. Ophthalmology. 2002;109 (8):1521–1526. doi: 10.1016/S0161-6420 (02)01109-0
11. Šínová I, Řehák J, Nekolová J, Jirásková NA, Haluzová P, Řeháková T, Bábková B, Hejsek L, Šín M. Correlation between ischemic index of retinal vein occlusion and oxygen saturation in retinal vessels. American Journal of Ophthalmology. 2018;188:74-80.
12. Tsai G, Banaee T, Conti FF, Singh RP. Optical Coherence Tomography Angiography in Eyes with Retinal Vein Occlusion. J Ophthalmic Vis Res. 2018;13(3):315–332. doi:10.4103/jovr.jovr_264_17
Lecture additionnelle
Zilia et l’Université de Kagawa lancent une étude sur l’oxygénation de la rétine au Japon
Québec, le 30 avril 2024 - Zilia, une entreprise québécoise spécialisée dans le développement de...
Le rôle complexe de l’oxygène dans la rétinopathie du prématuré
La naissance prématurée se présente comme l'un des accomplissements les plus notables de la médecine....
Le stress oxydatif et la santé des yeux
L'oxygène occupe une place primordiale dans notre univers, étant le troisième élément le plus abondant et le...
Solutions