Pourquoi l'œil est-il une fenêtre ouverte sur les pathologies du cerveau?
Les yeux sont souvent désignés comme le miroir de l’âme, mais ils sont également une fenêtre ouverte sur notre santé. Au stade embryonnaire, les connexions nerveuses s’établissent entre la rétine, le nerf optique et le cerveau en développement. Ces structures sont considérées comme faisant partie du système nerveux central.
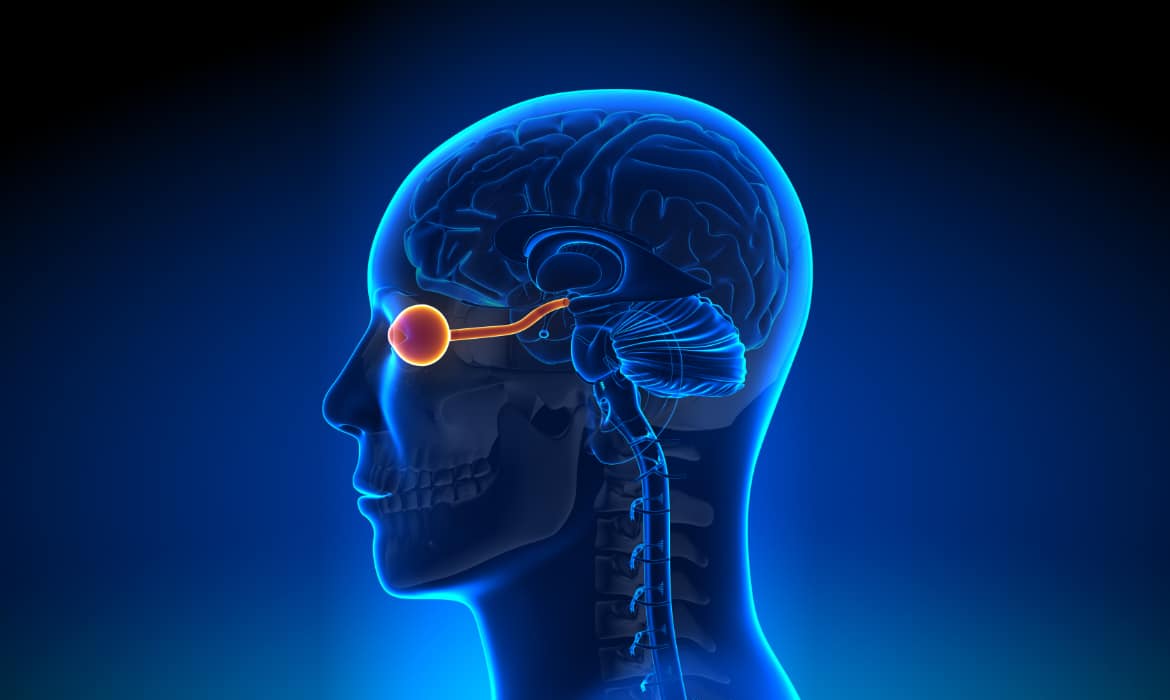
Lien avec le cerveau
De plus en plus d’études révèlent que des biomarqueurs de maladies neurodégénératives se trouvent dans l’œil. Ces nouveaux biomarqueurs ont des implications importantes pour les maladies neurologiques telles que la maladie d’Alzheimer, la maladie de Parkinson et la sclérose en plaques. Ainsi, la rétine neurosensorielle pourrait véritablement être une fenêtre sur les pathologies du cerveau.
La maladie d’Alzheimer, la forme la plus courante de démence, peut être difficile à diagnostiquer dans ses premiers stades. Les symptômes sont principalement non spécifiques et difficiles à distinguer des changements normaux liés à l’âge (1). Cependant, nous savons aujourd’hui que des changements métaboliques se produisent des années avant que les symptômes ne se manifestent (2). Les biomarqueurs rétiniens ont le potentiel d’offrir une méthode de détection et de diagnostic précoce de ces changements et peuvent avoir un impact considérable sur le fardeau socio-économique de ces maladies. Les avantages potentiels pour les patients et les systèmes de santé sont considérables.
Pour mieux comprendre les mécanismes vasculaires sous-jacents des maladies cérébrales, plusieurs études se sont intéressées à la saturation en oxygène.
Composante vasculaire
Le dysfonctionnement vasculaire contribue à la pathogenèse de nombreuses maladies oculaires, telles que le glaucome, la rétinopathie diabétique, la rétinopathie hypertensive et la dégénérescence maculaire liée à l’âge (3, 4). Par exemple, la rigidité des artères rétiniennes affecte le flux sanguin veineux (en particulier aux points de croisement artério-veineux), ce qui augmente le risque d’occlusion des veines rétiniennes. Les patients souffrant de diabète, d’hypertension ou d’hypercholestérolémie sont particulièrement à risque. Des altérations veineuses rétiniennes similaires sont suspectées dans la maladie de Parkinson (3). La détection précoce de ces changements peut aider à prévenir une atteinte fonctionnelle et à identifier les patients atteints d’une maladie préclinique.
Le couplage neurovasculaire, également appelé hyperémie fonctionnelle, décrit la relation entre l’activité neuronale et les variations du débit sanguin cérébral. Dans l’œil, la stimulation visuelle (par exemple, un scintillement de lumière) de la rétine entraîne une augmentation de l’activité neuronale, ce qui conduit à une augmentation du flux sanguin vers la rétine et le nerf optique (5). Ainsi, le couplage neurovasculaire permet à l’organisme de répondre aux exigences métaboliques du tissu nerveux.
Bien que les mécanismes du couplage neurovasculaire ne soient pas entièrement compris, des études suggèrent qu’un dysfonctionnement de ce système se produit dans diverses maladies neurodégénératives et vasculaires. Par exemple, des recherches montrent que le couplage neurovasculaire peut être affecté dans la maladie d’Alzheimer, dans laquelle la réponse des vaisseaux rétiniens à la lumière est réduite (6). D’autres études suggèrent que des événements similaires se produisent dans la sclérose en plaques, bien que des recherches supplémentaires soient nécessaires pour étayer cette théorie (7). La réponse vasculaire aux stimuli visuels est une méthode non invasive prometteuse pour diagnostiquer et surveiller les troubles neurologiques.
Saturation en oxygène
Pour mieux comprendre les mécanismes vasculaires sous-jacents des maladies cérébrales, plusieurs études se sont intéressées à un biomarqueur important de nombreuses maladies oculaires et systémiques : la saturation en oxygène. L’oxymétrie mesure la saturation en oxygène de l’hémoglobine, tandis que l’oxymétrie oculaire mesure la saturation en oxygène du sang dans la rétine. Tout comme le cerveau, la rétine a une demande métabolique élevée (8). L’altération du flux sanguin et de l’apport en oxygène dans la rétine peut entraîner des changements pathologiques importants. L’oxymétrie oculaire peut détecter ces changements d’oxygénation de la rétine dans les maladies oculaires et systémiques.
Des études montrent que la rétine présente une saturation en oxygène élevée dans la maladie d’Alzheimer (9). Dans la sclérose en plaques, les résultats de l’oxymétrie oculaire montrent une augmentation de la saturation veineuse en oxygène, ce qui indique une réduction de l’absorption d’oxygène. Les chercheurs pensent que la demande réduite en oxygène peut être liée à l’atrophie consécutive à la névrite optique chez les patients atteints de sclérose en plaques (10)
Conclusion
Le flux sanguin et l’oxygène jouent un rôle crucial dans le maintien de l’homéostasie. Les données actuelles montrent que les altérations de la régulation vasculaire et de la saturation en oxygène peuvent conduire à diverses pathologies du système nerveux central. Les biomarqueurs rétiniens permettent la détection précoce des maladies. Cependant, il existe un besoin criant pour des technologies permettant de fournir des mesures objectives de ces biomarqueurs.
Les oxymètres oculaires traditionnels fournissent des mesures relatives de saturation en oxygène dans les gros vaisseaux sanguins du fond de l’œil. Cette limitation empêche l’évaluation de tissus vascularisés des structures spécifiques telles que la rétine ou la tête du nerf optique. Le Zilia Ocular, en revanche, utilise tout le spectre de la lumière pour mesurer la saturation en oxygène de l’œil. Cette nouvelle plateforme technologique permet d’effectuer des mesures quantitatives en continu, ce qui donne un aperçu plus complet de l’oxygénation de la rétine.
D’autres études sont nécessaires pour valider le rôle de la saturation en oxygène et du dysfonctionnement vasculaire dans les maladies neurologiques, et d’autres biomarqueurs métaboliques doivent encore être découverts, mais le potentiel est énorme. Les nouvelles technologies, telles que Zilia Ocular, ont la capacité de révolutionner le diagnostic et la gestion des troubles neurodégénératifs, notamment la maladie d’Alzheimer, la sclérose en plaques et la maladie de Parkinson. Avec le vieillissement de la population mondiale, l’oxymétrie oculaire deviendra de plus en plus importante dans les milieux cliniques et de recherche.
Références
- Yap TE, Balendra SI, Almonte MT, Cordeiro MF. Retinal correlates of neurological disorders. Ther Adv Chronic Dis. 2019;10:2040622319882205. Published 2019 Dec 2. doi:10.1177/2040622319882205
- Morris JC. Early-stage and preclinical Alzheimer disease. Alzheimer Dis Assoc Disord. 2005;19(3):163-165. doi:10.1097/01.wad.0000184005.22611.cc
- Kromer R, Buhmann C, Hidding U, et al. Evaluation of retinal vessel morphology in patients with Parkinson’s disease using optical coherence tomography. PLoS One. 2016;11(8):e0161136. Published 2016 Aug 15. doi:10.1371/journal.pone.0161136
- Boeckaert J, Vandewalle E, Stalmans I. Oximetry: recent insights into retinal vasopathies and glaucoma. Bull Soc Belge Ophtalmol. 2012;(319):75-83
- Garhöfer G, Chua J, Tan B, Wong D, Schmidl D, Schmetterer L. Retinal neurovascular coupling in diabetes. J Clin Med. 2020;9(9):2829. Published 2020 Sep 1. doi:10.3390/jcm9092829
- Kotliar K, Hauser C, Ortner M, et al. Altered neurovascular coupling as measured by optical imaging: a biomarker for Alzheimer’s disease. Sci Rep. 2017;7(1):12906. Published 2017 Oct 10. doi:10.1038/s41598-017-13349-5
- Stickland R, Allen M, Magazzini L, Singh KD, Wise RG, Tomassini V. Neurovascular coupling during visual stimulation in multiple sclerosis: A MEG-fMRI study. Neuroscience. 2019;403:54-69. doi:10.1016/j.neuroscience.2018.03.018
- Country MW. Retinal metabolism: A comparative look at energetics in the retina. Brain Res. 2017;1672:50-57. doi:10.1016/j.brainres.2017.07.025
- Stefánsson E, Olafsdottir OB, Eliasdottir TS, et al. Retinal oximetry: Metabolic imaging for diseases of the retina and brain. Prog Retin Eye Res. 2019;70:1-22. doi:10.1016/j.preteyeres.2019.04.001
- Einarsdottir AB, Hardarson SH, Kristjansdottir JV, Bragason DT, Snaedal J, Stefánsson E. Retinal oximetry imaging in Alzheimer’s disease. J Alzheimers Dis. 2016;49(1):79-83. doi:10.3233/JAD-150457
- Einarsdottir AB, Olafsdottir OB, Hjaltason H, Hardarson SH. Retinal oximetry is affected in multiple sclerosis. Acta Ophthalmol. 2018;96(5):528-530. doi:10.1111/aos.13682
Écrit par l’équipe de Zilia le 20 avril 2021
Lecture additionnelle
Zilia et l’Université de Kagawa lancent une étude sur l’oxygénation de la rétine au Japon
Québec, le 30 avril 2024 - Zilia, une entreprise québécoise spécialisée dans le développement de...
Le rôle complexe de l’oxygène dans la rétinopathie du prématuré
La naissance prématurée se présente comme l'un des accomplissements les plus notables de la médecine....
Le stress oxydatif et la santé des yeux
L'oxygène occupe une place primordiale dans notre univers, étant le troisième élément le plus abondant et le...
Solutions