Rétinopathie diabétique: Un rôle clé pour l'oxymétrie oculaire?
La rétinopathie diabétique (RD) est la complication la plus courante du diabète (DS). C’est une maladie de la rétine caractérisée par de l’ischémie, de la néovascularisation et de l’œdème.

Sur le plan clinique, on distingue deux types de RD: non proliférante et proliférante. La rétinopathie diabétique non proliférante (RDNP) représente un stade plus précoce de la maladie et se manifeste par une perméabilité vasculaire accrue et une occlusion capillaire. Même si les patients peuvent être asymptomatiques, l’examen peut permettre d’observer des microanévrismes, des hémorragies et des exsudats au niveau de la rétine. La rétinopathie diabétique proliférante (RDP) est un stade plus avancé de la maladie et se caractérise surtout par de la néovascularisation, c’est-à-dire la formation de nouveaux vaisseaux sanguins anormaux en réponse à une mauvaise circulation. La RDP peut provoquer une hémorragie du vitré ou un décollement de rétine tractionnel, ce qui peut entraîner une grave déficience visuelle. (1)
Le diabète devrait toucher 640 millions d’adultes dans le monde d’ici 2040. La RD touche 1 diabétique sur 3 et est la principale cause de perte de vision chez les adultes en âge de travailler. (2) Dix ans après le diagnostic de diabète, 71 à 90 % des patients de type 1 et 67 % des patients de type 2 présentent des signes de RD. (3)
Stratégies de prévention de la cécité causée par la RD
Il existe trois grandes approches pour prévenir la cécité due à la RD. La première est la prévention primaire, qui consiste à modifier le mode de vie, à utiliser des médicaments et à procéder à un dépistage systématique dans le but de prévenir la RD. La prévention secondaire tente de diminuer la progression de la RD par le contrôle des facteurs de risque systémiques, des dépistages oculaires réguliers et l’application de directives fondées sur des données probantes. Enfin, la prévention tertiaire de la cécité due à la RD implique l’utilisation de traitements ophtalmiques tels que la photocoagulation au laser et la chirurgie pour gérer la progression de la maladie. Pour lutter efficacement contre la cécité causée par la RD, il est impératif de se concentrer sur des mesures de prévention primaire et secondaire.(2)
L’importance d’un diagnostic précoce
On estime que la RD commence à se développer jusqu’à 7 ans avant le diagnostic de diabète. Par conséquent, la RD peut souvent être identifiée lors de la première visite suivant le diagnostic de diabète.(4) Une fois la RD diagnostiquée, il est nécessaire d’atténuer la progression de la maladie pour minimiser le risque de cécité. Par exemple, selon l’étude sur le traitement précoce de la rétinopathie diabétique (ETDRS) et l’étude sur la rétinopathie diabétique (DRS), l’administration d’une photocoagulation au laser en temps opportun a le potentiel de réduire de 90 % la perte visuelle sévère. Néanmoins, la détection précoce et le traitement de la RD restent un défi pour les prestataires de soins de santé.(3)
Une avancée majeure dans la gestion de la RD serait la possibilité de mesurer les niveaux de saturation en oxygène oculaire afin d’évaluer les changements métaboliques avant que les dommages ne se produisent.
Diagnostic de la rétinopathie diabétique
Penchons-nous sur la manière dont nous détectons et suivons la maladie aujourd’hui.
Ophtalmoscopie
Lorsqu’un patient atteint de diabète est vu par un professionnel des soins de la vue, une ophtalmoscopie dilatée est effectuée. Ce test, pratiqué par un ophtalmologiste ou un optométriste, a une sensibilité de 65,7 % et une spécificité de 93,8 % pour détecter les signes de la RD.(3)
Photographie du fond de l’œil
La photographie de la rétine peut aider à identifier et à documenter la présence ou l’absence de RD. La nature statique de la photographie permet une plus grande certitude au niveau de l’observation. Le champ de vision plus large d’une photographie par rapport à l’image en ophtalmoscopie directe permet à l’examinateur d’avoir une vue plus large de l’œil. La comparaison d’images en série est également possible, ce qui permet de visualiser les changements dans le temps.
Tomographie par cohérence optique
La tomographie par cohérence optique (OCT) est un autre outil utilisé pour surveiller la RD. L’OCT permet de mesurer l’épaisseur de la rétine, ce qui est particulièrement utile en cas de suspicion clinique d’œdème maculaire. L’emplacement et l’aspect de l’œdème maculaire peuvent être caractérisés par une analyse des images. De plus, l’angiographie par OCT (OCT-A), qui est une modalité d’imagerie permettant la visualisation tridimensionnelle du réseau capillaire de la rétine et du nerf optique, peut aider à identifier les microanévrismes, les changements à la paroi artériolaire, la néovascularisation rétinienne et les anomalies microvasculaires intrarétiniennes.(6)
Angiographie à la fluorescéine
Bien que l’OCT et l’OCT-A soient de plus en plus utilisés en raison de leur caractère non invasif, l’angiographie à la fluorescéine reste la méthode de référence pour évaluer l’ischémie et l’œdème maculaire. Cependant, elle est coûteuse en temps et argent, nécessite une ponction veineuse, en plus de présenter des risques d’anaphylaxie et de décès.(6)
Malgré que les tests précédemment listés aient prouvé leur capacité à diagnostiquer la RD avec précision, ils se concentrent principalement sur l’évaluation des dommages déjà causés à l’œil.
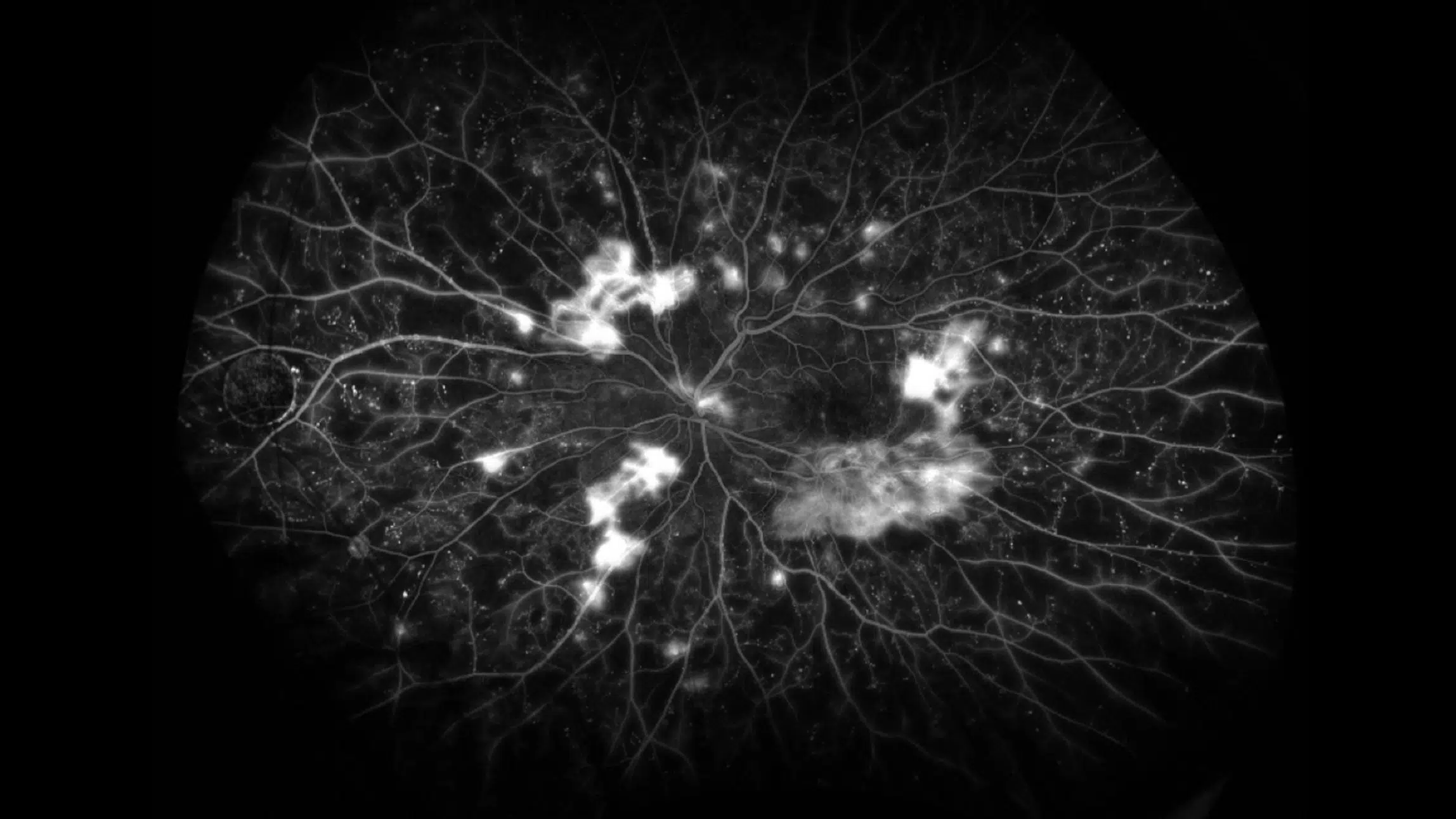
Rétinopathie diabétique proliférante observée lors d’une angiographie à la fluorescéine à ultra-large champ. Source : https://collaborativeeye.com/
Oxymétrie oculaire
De plus en plus d’études montrent que le dérèglement de l’oxygène dans l’œil est un indicateur clé de la perte de la fonction métabolique et pourrait donc représenter un facteur physiopathologique crucial de la RD. Ainsi, une avancée majeure dans la gestion de la RD serait la possibilité de mesurer les niveaux de saturation en oxygène oculaire afin d’évaluer les changements métaboliques avant que les dommages ne se produisent et d’aider à prédire le pronostic visuel et la réponse au traitement.
Au cours des dernières années, la saturation en oxygène de la rétine s’est avérée être un facteur de risque pour le développement de la RD. Plus précisément, Veibi et al ont étudié la saturation en oxygène artérioveineuse chez de jeunes patients atteints de diabète de type 1 et ont constaté que des niveaux plus faibles étaient un facteur de risque pour le développement de la RDNP.(7)
En outre, il a été démontré que les paramètres d’oxymétrie oculaire changent avant que l’on puisse identifier une progression mesurable de la RD. Par exemple, la saturation en oxygène dans les gros vaisseaux rétiniens peut augmenter et la différence artério-veineuse peut diminuer avec le temps. Cela suggère que l’oxymétrie oculaire est soit plus sensible à ces changements, soit que ces changements précèdent la progression de la RD.(8)
Ainsi, en utilisant l’oxymétrie oculaire pour suivre la fonction métabolique au fil du temps, nous pourrions modifier considérablement l’approche de la prévention, du dépistage et du traitement de la RD dans le monde entier. Les nouvelles technologies telles que le Zilia Ocular sont porteuses d’espoir sur ce point, car elles permettent de mieux comprendre la santé vasculaire de la rétine et l’état métabolique de l’œil. L’oxymétrie oculaire a le potentiel de devenir un outil clinique important dans la RD en permettant de mesurer la gravité de la RD et de prédire la réponse au traitement.
Conclusion
Le nombre d’Américains atteints de RD est en augmentation. Entre 2010 et 2050, ce chiffre devrait presque doubler, passant de 7,7 à 14,6 millions.(9) La RD est une maladie traitable, mais une intervention précoce est essentielle pour mettre en place des traitements adéquats afin de prévenir la perte de vision. Les nouvelles technologies nous donnent accès à des nouvelles informations sur le métabolisme oculaire et nous permettent d’entrevoir un monde sans cécité causée par le diabète.
Références
1. Wang W, Lo ACY. Diabetic Retinopathy: Pathophysiology and Treatments. Int J Mol Sci. 2018;19(6):1816. Published 2018 Jun 20. doi:10.3390/ijms19061816
2. Wong TY, Sabanayagam C. Strategies to Tackle the Global Burden of Diabetic Retinopathy: From Epidemiology to Artificial Intelligence. Ophthalmologica. 2020;243(1):9-20. doi:10.1159/000502387
3. Vashist P, Singh S, Gupta N, Saxena R. Role of early screening for diabetic retinopathy in patients with diabetes mellitus: an overview. Indian J Community Med. 2011;36(4):247-252. doi:10.4103/0970-0218.91324
4. Jimenez-Baez MV, Marquez-Gonzalez H, Barcenas-Contreras R, Morales Montoya C, Espinosa-Garcia LF. Early diagnosis of diabetic retinopathy in primary care. Colomb Med (Cali). 2015;46(1):14-18. Published 2015 Mar 30.
5. Murgatroyd H, Ellingford A, Cox A, et al. Effect of mydriasis and different field strategies on digital image screening of diabetic eye disease. Br J Ophthalmol. 2004;88(7):920-924. doi:10.1136/bjo.2003.026385
6. de Barros Garcia JMB, Isaac DLC, Avila M. Diabetic retinopathy and OCT angiography: clinical findings and future perspectives. Int J Retina Vitreous. 2017;3:14. Published 2017 Mar 13. doi:10.1186/s40942-017-0062-2
7. Veiby NCBB, Simeunovic A, Heier M, et al. Retinal venular oxygen saturation is associated with non-proliferative diabetic retinopathy in young patients with type 1 diabetes [published online ahead of print, 2021 Oct 20]. Acta Ophthalmol. 2021;10.1111/aos.15018. doi:10.1111/aos.15018
8. Hardarson SH, Stefánsson E, Bek T. Retinal oxygen saturation changes progressively over time in diabetic retinopathy. PLoS One. 2021;16(5):e0251607. Published 2021 May 12. doi:10.1371/journal.pone.0251607
9. Nei.nih.gov. n.d. Diabetic Retinopathy Data and Statistics | National Eye Institute. [online] Available at: <https://www.nei.nih.gov/learn-about-eye-health/outreach-campaigns-and-resources/eye-health-data-and-statistics/diabetic-retinopathy-data-and-statistics>
Publié par l’équipe Zilia le 26 novembre 2021
Lecture additionnelle
Zilia et l’Université de Kagawa lancent une étude sur l’oxygénation de la rétine au Japon
Québec, le 30 avril 2024 - Zilia, une entreprise québécoise spécialisée dans le développement de...
Le rôle complexe de l’oxygène dans la rétinopathie du prématuré
La naissance prématurée se présente comme l'un des accomplissements les plus notables de la médecine....
Le stress oxydatif et la santé des yeux
L'oxygène occupe une place primordiale dans notre univers, étant le troisième élément le plus abondant et le...
Solutions